NOTÍCIES
NOTÍCIES
Diabetes-causing gene can be regulated like a rheostat
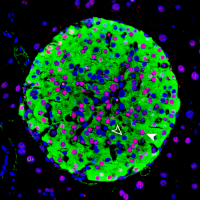
Image of a mouse pancreatic islet, regions in the pancreas that contain beta cells which secret insulin. The HASTER regulatory element has been knocked out in this mouse, resulting in changes to beta cell function that cause diabetes. Credit: Miguel A Garriga/CRG
Researchers at the Centre for Genomic Regulation (CRG) and Imperial College London have found a switch that regulates the activity of a gene that causes diabetes. The findings, published in Nature Cell Biology, highlights potential new vulnerabilities in the disease and could lead to the development of new therapeutic strategies.
HNF1A is a gene that provides instructions for making a protein called hepatocyte nuclear factor-1 alpha. The protein is expressed in many tissues but is particularly important for the pancreas, where it plays a role in developing beta cells. Beta cells produce the hormone insulin, which regulate blood sugar levels.
Mutations in HNF1A cause cells to create a protein that doesn’t work normally, which in turn affects the function of beta cells. This results in individuals developing a disease known as maturity-onset diabetes of the young, where symptoms such as high blood sugar can appear before individuals reach the age of 30.
Though this disease accounts for just 1% of all types of diabetes, it is high in terms of absolute numbers due to the high prevalence of diabetes amongst the worldwide population (5-10%). HNF1A is also known to play a key role in the susceptibility for the more common form of the disease, type 2 diabetes, in concert with other genetic and non-genetic factors.
Understanding how the HNF1A gene is switched on or off in beta cells could have important implications for understanding why defects in this gene lead to diabetes, or how it could be harnessed to correct the underlying problem. Using a combination of mouse and human models, researchers have now focused on an enigmatic part of the genome near HNF1A that has a unique function that has not been described before. This DNA regulatory element works like as rheostat; if the HNF1A gene transcribes too much it dials it down, if the gene is slacking it dials it back up.
“We coined this a stabilizer, in contrast to other DNA regulatory elements such as enhancers, promoters and silencers, and call this particular element HASTER, for HNF1A stabilizer,” explains Jorge Ferrer, Senior Researcher at the CRG and Group Leader at CIBERDEM.
The vast majority of RNA molecules synthesized inside cells do not code for proteins. HASTER controls the production of a class of these RNA molecules known as long non-coding RNAS, (lncRNAS)“This is intriguing because there are tens of thousands of lncRNAs in the human genome, most of which have no known function. It very likely that that there are many lncRNAs in our genome with a similar function to HASTER. If so, they could play a significant role in human disease,” says Dr. Anthony Beucher, first author of the study.
The researchers showed that mutations in HASTER cause diabetes in mice. “This is important, because it proves that this type of element is critically important, the consequences of deleting HASTER are comparable to deleting HNF1A itself. HASTER could be a useful handle to manipulate HNF1A therapeutically” says Dr. Ferrer.
The study is an example of how studying the non-protein coding sequences in a genome can yield new ways to understand and treat disease. Just 1-2% of the human genome consists of protein-coding sequences. The remaining ‘dark matter’ is thought to include tens of thousands of regions that regulate gene expression.
By showing that changes to the function of gene regulatory elements such as HASTER can drastically change cell function akin to disrupting the gene itself, the researchers pave the way for future studies that explore the role of non-protein coding sequences in promoting disease.
“A lot more space in the human genome is devoted to regulating genes than to the genes themselves. In this study we have experimentally validated just one region to ascertain its function. It’s likely this is just the tip of the iceberg,” concludes Dr. Ferrer.
The study features on the cover of this month’s edition of Nature Cell Biology, and is included in a collection of articles from across Nature research journals that discuss recent technological advances in noncoding RNA biology.
“Although noncoding RNAs were initially considered to be degradation products of RNA turnover and metabolism, and were often neglected, increasing evidence has demonstrated their regulatory and functional roles in diverse cellular compartments and macromolecular structures and in a wide range of contexts spanning differentiation, disease and metabolism,” says an accompanying editorial in Nature Cell Biology.
EN CASTELLANO
Un gen causante de la diabetes se puede regular como un reóstato
Equipos científicos del Centro de Regulación Genómica (CRG) y el Imperial College de Londres han descubierto un interruptor que regula la actividad de un gen que causa diabetes. Los hallazgos, publicados en Nature Cell Biology, revelan posibles nuevas vulnerabilidades en la enfermedad y podrían conducir al desarrollo de nuevas estrategias terapéuticas.
HNF1A es un gen que proporciona las instrucciones para producir una proteína llamada factor nuclear 1 alpha de hepatocitos. La proteína se expresa en muchos tejidos, y es particularmente importante para el páncreas, donde desempeña un papel en el desarrollo de las células beta. Las células beta producen la hormona insulina, que regula los niveles de azúcar en la sangre.
Las mutaciones en HNF1A hacen que las células construyan una proteína que no funciona como debería y que perjudica la función de las células beta. Esto hace que las personas desarrollen una enfermedad conocida como diabetes del adulto de inicio juvenil, donde los síntomas como el alto nivel de azúcar en la sangre pueden aparecer antes de que las personas alcancen la edad de 30 años.
Aunque esta enfermedad representa solo el 1% de todos los tipos de diabetes, su prevalencia es alta en términos de números absolutos debido a que entre 5 y 10% de la población mundial tiene diabetes. HNF1A también desempeña un papel clave en la susceptibilidad a la forma más común de la enfermedad, la diabetes tipo 2, junto con otros factores genéticos y no genéticos.
Comprender cómo se activa o desactiva el gen HNF1A en las células beta podría tener implicaciones importantes para comprender por qué los defectos en este gen conducen a la diabetes, o cómo podría aprovecharse para corregir el problema subyacente.
Usando una combinación de modelos de ratón y de humanos, el estudio se centra en una parte enigmática del genoma cercana a la ubicación del HNF1A. Descubrieron que esta región - también conocida como un elemento regulador del ADN - tiene una función única que no se ha descrito antes: funciona como un reóstato. Si el gen HNF1A transcribe demasiado, HASTER lo controla y rebaja su actividad, si el gen está aflojando, HASTER ajusta la intensidad y aumenta su expresión.
"Lo hemos denominado estabilizador, en contraste con otros elementos reguladores del ADN como potenciadores, promotores y silenciadores, y llamamos a este elemento en particular HASTER, por ser un estabilizador del HNF1A", explica el Dr. Jorge Ferrer, investigador principal del CRG y jefe de grupo del CIBERDEM, el Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas.
La gran mayoría de las moléculas de ARN sintetizadas dentro de las células no codifican proteínas. HASTER controla la producción de una clase de estas moléculas de ARN denominadas moléculas largas de ARN no codificantes, también conocidas como lncRNAs en inglés.
"Esto es interesante porque hay decenas de miles de lncRNAs en el genoma humano, la mayoría de los cuales no tienen una función conocida. Es muy probable que haya muchos lncRNAs en nuestro genoma con una función similar a HASTER. Si es así, podrían desempeñar un papel importante en la enfermedad humana", afirma el Dr. Anthony Beucher, primer autor del estudio.
El estudio demuestra que las mutaciones en HASTER causan la diabetes en ratones. "Esto es importante, porque demuestra que este tipo de elemento es crítico. Las consecuencias de eliminar HASTER son comparables a eliminar HNF1A en sí. HASTER podría ser una manera útil de manipular HNF1A terapéuticamente", dice el Dr. Ferrer.
El estudio es un ejemplo de cómo el estudio de las secuencias genómicas que no codifican proteínas puede desvelar nuevas formas de comprender y tratar las enfermedades. Solo el 1-2% del genoma humano consiste en secuencias codificantes de proteínas. Se cree que la "materia oscura" restante incluye decenas de miles de regiones que regulan la expresión génica.
Al demostrar que los cambios en la función de los elementos reguladores de genes como HASTER pueden cambiar drásticamente la función celular similar a la interrupción del gen en sí, los investigadores allanan el camino para futuros estudios que exploren el papel de las secuencias no codificantes y como promueven la enfermedad.
"El genoma humano dedica mucho más espacio a regular los genes que a los genes mismos. En este estudio hemos validado experimentalmente sólo una región para determinar su función. Es probable que esto sea solo la punta del iceberg", concluye el Dr. Ferrer.
El estudio aparece en la portada de la revista de este mes de Nature Cell Biology y está incluido en una colección de artículos procedentes de las diferentes revistas del grupo Nature, centrada en el análisis de los avances tecnológicos recientes en la biología del ARN no codificante.
“Aunque inicialmente se consideró que los ARN no codificantes eran productos de degradación de la renovación y el metabolismo del ARN, y a menudo se los ignoraba, el incremento de pruebas ha demostrado sus funciones reguladoras y funcionales en diversos compartimentos celulares y estructuras macromoleculares y en una amplia gama de contextos que abarcan la diferenciación, la enfermedad y el metabolismo”, dice un editorial adjunto en Nature Cell Biology.
EN CATALÀ
Un gent causant de la diabetis pot regular-se com un reòstat
Equips científics del Centre de Regulació Genòmica (CRG) i l’Imperial College de Londres han descobert un interruptor que regula l’activitat d’un gen que causa la diabetis. Les troballes, publicades a Nature Cell Biology, revelen possibles noves vulnerabilitats en la malaltia i podrien conduir al desenvolupament de noves estratègies terapèutiques.
HNF1A és un gen que proporciona les instruccions per a produir una proteïna anomenada factor nuclear 1 alpha d’hepatòcits. La proteïna s’expressa en molts teixits, i és particularment important per al pàncrees, on executa una funció en el desenvolupament de les cèl·lules beta. Les cèl·lules beta produeixen l’hormona insulina, que regula els nivells de sucre a la sang.
Les mutacions a HNF1A fan que les cèl·lules construeixin una proteïna que no funciona bé i que perjudica la funció de les cèl·lules beta. Això fa que les persones desenvolupin una malaltia coneguda com diabetis de l’adult d’inici juvenil, on els primers símptomes, com l’alt nivell de sucre a la sang poden aparèixer abans què les persones arribin als 30 anys.
Tot i que aquesta malaltia representa només l’1% de tots els tipus de diabetis, la seva prevalença és alta en termes de números absoluts, ja que entre el 5 i el 10% de la població mundial té diabetis. HNF1A també desenvolupa un paper clau en la susceptibilitat a la forma més comuna de la malaltia, la diabetis tipus 2, juntament amb d’altres factors genètics i no genètics.
Comprendre com s’activa o desactiva el gen HNF1A a les cèl·lules beta podria tenir implicacions importants per a comprendre per què els defectes en aquest gen condueixen a la diabetis, o com podria aprofitar-se per corregir el problema subjacent.
Emprant una combinació de models de ratolí i d’humans, l’estudi se centra en una part enigmàtica del genoma propera a la ubicació d’HNF1A. Descobriren que aquesta regió –també coneguda com a un element regulador de l’ADN- té una funció única que no s’ha descrit abans: funciona com un reòstat. Si el gen HNF1A transcriu massa, la regió el controla i rebaixa la seva activitat, si el gen està afluixant, ajusta la intensitat i n’augmenta l’expressió.
“L’hem denominat estabilitzador, en contrast amb d’altres elements reguladors de l’ADN com potenciadors, promotors i silenciadors, i anomenem a aquest element en particular HASTER, per ésser un estabilitzador d’HNF1A”, explica el Dr. Jorge Ferrer, investigador principal del CRG i cap de grup del CIBERDEM, el Centre de Recerca Biomèdica en Xarxa de Diabetis i Malalties Metabòliques Associades.
La gran majoria de les molècules d’ARN sintetitzades dins de les cèl·lules no codifiquen proteïnes. HASTER controla la producció d’una classe d’aquestes molècules d’ARN denominades molècules llargues d’ARN no codificants, també conegudes con IncRNAs en anglès.
“Això és interessant perquè hi ha desenes de milers d’IncRNAs al genoma humà, la majoria dels quals no tenen una funció coneguda. És molt probable que hi hagi molts IncRNAs al nostre genoma amb una funció similar a HASTER. Si és així, podrien exercir un paper important en la malaltia humana”, afirma el Dr. Anthony Beucher, primer autor de l’estudi.
L’estudi demostra que les mutacions a HASTER causen la diabetis en ratolins. “Això és important, perquè demostra que aquest tipus d’element és crític. Les conseqüències d’eliminar HASTER són comparables a eliminar HNF1A en si mateix. HASTER podria ser una manera útil de manipular HNF1A terapèuticament”, diu el Dr. Ferrer.
L’estudi és un exemple de com l’estudi de les seqüències genòmiques que no codifiquen proteïnes pot desvelar noves formes de comprendre i tractar les malalties. Només l’1-2% del genoma humà consisteix en seqüències codificants de proteïnes. Es creu que la “matèria obscura” restant inclou desenes de milers de regions que regulen l’expressió gènica.
En demostrar que els canvis en la funció dels elements reguladors de gens com HASTER poden canviar dràsticament la funció cel·lular similar a la interrupció del gen en si mateix, els investigadors aplanen el camí per a futurs estudis que explorin el paper de les seqüències no codificants i com promouen la malaltia.
“El genoma humà dedica molt més espai a regular els gens que als mateixos gens. En aquest estudi hem validat experimentalment només una regió per a determinar la seva funció. És probable que això sigui només la punta de l’iceberg”, conclou el Dr. Ferrer.
L’estudi apareix a la portada de la revista Nature Cell Biology d’aquest mes i està inclòs en una col·lecció d’articles procedents de les diferents revistes del grup Nature, centrada en l’anàlisi dels avenços tecnològics recents en la biologia de l’ARN no codificant.
“Tot i que inicialment es considerà que els ARN no codificants eren productes de degradació de la renovació i el metabolisme de l’ARN, i sovint se’ls ignorava, l’increment de proves ha demostrat les seves funcions reguladores i funcionals en diversos compartiments cel·lulars i estructures macromoleculars i en una àmplia gamma de contextos que inclouen la diferenciació, la malaltia i el metabolisme”, diu un editorial adjunt a Nature Cell Biology.