How Oocytes Outsmart Toxic Proteins to Preserve Long-term Female Fertility
How Oocytes Outsmart Toxic Proteins to Preserve Long-term Female Fertility
How Oocytes Outsmart Toxic Proteins to Preserve Long-term Female Fertility
Oocytes are immature egg cells that develop in almost all female mammals before birth. The propagation of future generations depends on this finite reserve of cells surviving for many years without incurring damage. In mice, this can be a period of up to eighteen months, while in humans it can last almost half a century, the average time between birth and menopause. How the cells accomplish this remarkable feat of longevity has been a longstanding question.
Researchers at the Centre for Genomic Regulation (CRG) in Barcelona have discovered a new mechanism which explains how oocytes remain in pristine conditions for decades without succumbing to the wear and tear that would cause other cell types to fail. The findings, reported today in the journal Cell, represent a new frontier to explore unexplained causes of infertility.
The researchers looked at protein aggregates, which are clumps of misfolded or damaged proteins. If left unchecked, these harmful substances accumulate in the cytoplasm and have highly toxic effects. Protein aggregates are known to accumulate in neurons and their effects have been linked to several neurodegenerative diseases. Cells usually manage aggregates by breaking them down with specialized enzymes. They can also divide into two new cells, concentrating aggregates in one of the cells and sparing the other.
But oocytes are not like the other cells. Their long life means they cannot dissipate toxic substances through cell division. Constantly breaking down protein aggregates is an inviable strategy, as it requires using a high amount of energy that may not be available. Oocytes also have the job of donating their entire cytoplasm to an embryo after fusing with a sperm, and so prefer to reduce their metabolic activity, a strategy which avoids generating by-products which can damage the maternal DNA and compromise future reproductive success. This makes oocytes particularly sensitive to the effects of misfolded or damaged proteins.
However, “in contrast to the tens of thousands of papers on protein aggregation in neurons, how mammalian oocytes cope with protein aggregation is essentially unstudied, despite having the same problem of being long-lived and non-dividing”, explains Dr. Elvan Böke, Group Leader of the Oocyte Biology & Cellular Dormancy programme at the Centre for Genomic Regulation and author of the study. “We wanted to explore how oocytes deal with these misfolded or damaged proteins”, adds Dr. Böke.
Patrolling ‘clean-up crews’
Dr. Böke’s team, led by Dr. Gabriele Zaffagnini, started by collecting thousands of immature oocytes, mature eggs, and early embryos from adult mice. Using special dyes, they observed how the protein aggregates behave in real-time using a technique called live-cell imaging. They also used electron microscopy to get a closer look and see nanoscopic details inside cells, work that took five and a half years to complete.
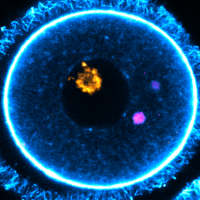
The researchers discovered special structures in the oocytes which they named EndoLysosomal Vesicular Assemblies – or ELVAs for short. These structures – there are about 50 per each oocyte - roam the cytoplasm, where they capture and hold onto protein aggregates, rendering them harmless. Cells have many subcellular structures known as organelles, which perform jobs much like an organ does in the body. The researchers conceptualise ELVAs as a “superorganelle” because it is a network of many different types of cellular components working together as a single unit.
The study revealed a crucial moment during the oocyte maturation stage, which is when an oocyte converts into a mature egg, preparing for ovulation and possible fertilisation. During this stage, the researchers observed ELVAs moving towards the cell's surface and breaking down the protein aggregates, essentially deep-cleaning the cytoplasm. This is the first observation of the unique strategy oocytes employ to get rid of protein aggregates.
“An oocyte must donate all its cytoplasm to the embryo at fertilisation, so it cannot afford for garbage to accumulate, which would pose an existential risk for its function. In that sense, ELVAs are like a sophisticated waste disposal network or clean-up crew, patrolling the cytoplasm to ensure no aggregates are freely floating. ELVAs keep these aggregates in a confined environment until the oocyte is ready to dispose of them in one fell swoop. It’s an effective and energy-efficient strategy,” says Dr. Zaffagnini, postdoctoral researcher at the Centre for Genomic Regulation.
Protein aggregates may contribute to infertility
Fertility declines with age, and poor oocyte quality is the major cause of female infertility. Global infertility rates are also on the rise, with delayed motherhood being one of the contributing factors. Understanding how oocytes remain healthy, and what causes these strategies to fail with age, is critical for understanding unexplained causes of infertility and open up new avenues for treatment.
The findings of the study suggest that the presence of protein aggregates could interfere with both egg and embryo quality. When the researchers experimentally prevented the ability of ELVAs to degrade protein aggregates during the oocyte maturation process, it led to the formation of defective eggs. When the researchers intervened and “forced” the embryos to inherit aggregated proteins, 3 in 5 (60%) failed to complete very early stages of development.
“A lot of studies have historically focused on one small aspect of why oocyte quality declines, which are meiosis and euploidy. However, a recent review of eleven thousand embryo transfers has shown that the decline in female fertility with age are heavily influenced by other, yet unknown factors. Our research opens a fascinating future direction to explore whether protein degradation, and problems with how they are regulated in oocytes, could explain the age-related decline in embryo health,” concludes Dr. Böke.
Another type of long-lived cell which do not divide yet have to deal with protein aggregates are neurons. The accumulation of the harmful substances in these cells is linked to the development of several types of neurodegenerative diseases including Alzheimer’s. Could ELVA-like compartments also exist in neurons and other cell types? The study opens the door for future research avenues beyond the field of reproduction.
EN CASTELLANO
Los ovocitos retienen y degradan proteínas tóxicas para preservar la fertilidad a largo plazo
Los ovocitos son óvulos inmaduros que se desarrollan en casi todas las hembras mamíferas antes del nacimiento. La propagación de generaciones futuras depende de que esta reserva finita de células sobreviva durante muchos años sin sufrir daños. En ratones, esto puede ser un período de hasta dieciocho meses, mientras que en humanos puede durar casi medio siglo, el tiempo promedio entre el nacimiento y la menopausia. Cómo las células logran esta hazaña de longevidad es un misterio.
Un equipo del Centro de Regulación Genómica (CRG) de Barcelona ha descubierto un nuevo mecanismo que explica cómo los ovocitos permanecen en perfectas condiciones durante décadas sin sucumbir al desgaste que provocaría el fracaso en otros tipos celulares. Los hallazgos, publicados en la revista Cell, representan una nueva frontera para explorar las causas inexplicables de la infertilidad.
El estudio se centra en los agregados de proteínas, que son grupos de proteínas mal plegadas o dañadas. Si no se controlan, estas sustancias nocivas se acumulan en el citoplasma y tienen efectos altamente tóxicos. Se sabe que los agregados de proteínas se acumulan en las neuronas y sus efectos se han relacionado con varias enfermedades neurodegenerativas. Por lo general, las células manejan los agregados descomponiéndolos con enzimas especializadas. También pueden dividirse en dos nuevas células, concentrando los agregados en una de las células, sin afectar a la otra.
Pero los ovocitos no son como las otras células. Su larga vida significa que no pueden disipar sustancias tóxicas a través de la división celular. Descomponer constantemente los agregados de proteínas es una estrategia inviable, ya que requiere usar mucha energía que puede no estar disponible. Los ovocitos también donan todo su citoplasma a un embrión tras fusionarse con un espermatozoide, por lo que prefieren reducir su actividad metabólica, una estrategia que evita generar subproductos que puedan dañar el ADN materno y comprometer el éxito reproductivo. Esto hace que los ovocitos sean particularmente sensibles a los efectos de las proteínas mal plegadas o dañadas.
Sin embargo, "a diferencia de las decenas de miles de artículos sobre la agregación de proteínas en las neuronas, cómo los ovocitos de los mamíferos se enfrentan a la agregación de proteínas está esencialmente sin estudiar, a pesar de tener el mismo problema de ser longevos y no dividirse", explica la Dra. Elvan Böke, jefa de grupo de Biología de Ovocitos y Latencia Celular del Centro de Regulación Genómica y autora del estudio. "Queríamos explorar cómo los ovocitos lidian con estas proteínas mal plegadas o dañadas", añade la Dra. Böke.
"Equipos de limpieza" patrullando
El equipo de la Dra. Böke, dirigido por el investigador posdoctoral Dr. Gabriele Zaffagnini, comenzó recolectando miles de ovocitos inmaduros, óvulos maduros y embriones en estado de desarrollo temprano de ratones. Usando tintes especiales, observaron cómo se comportan los agregados de proteínas en tiempo real utilizando una técnica de imagen especial. También utilizaron la microscopía electrónica para observar los detalles nanoscópicos dentro de las células. El estudio tardó cinco años y medio en completarse.
Descubrieron estructuras especiales en los ovocitos a las que llamaron Conjuntos Vesiculares EndoLisosomales, o ‘ELVAs’ por su acrónimo en inglés. Estas estructuras -hay unas 50 por cada ovocito- deambulan por el citoplasma, donde capturan y retienen los agregados proteicos, haciéndolos inofensivos. Las células tienen estructuras subcelulares conocidas como orgánulos, que realizan trabajos muy parecidos a los de un órgano en el cuerpo. Los autores del estudio conceptualizan los ELVA como un "superorgánulo" porque es una red de muchos tipos diferentes de componentes celulares que trabajan juntos como una sola unidad.
El estudio reveló un momento crucial durante la etapa de maduración del ovocito: cuando un ovocito se convierte en un óvulo maduro, preparándose para la ovulación y la posible fecundación. Durante esta etapa, se observó que los ELVA se mueven hacia la superficie de la célula y descomponen los agregados de proteínas, esencialmente limpiando el citoplasma en profundidad. Esta es la primera observación de la singular estrategia que emplean los ovocitos para deshacerse de los agregados de proteínas.
"Un ovocito debe donar todo su citoplasma al embrión en el momento de la fecundación, por lo que no puede permitir que se acumule basura, lo que supondría un riesgo existencial para su función. En ese sentido, los ELVA son como una sofisticada red de eliminación de residuos o un equipo de limpieza que patrulla por el citoplasma para asegurarse de que no haya agregados flotando libremente. Los ELVA mantienen estos agregados en un ambiente confinado hasta que el ovocito esté listo para deshacerse de ellos de una sola vez. Es una estrategia eficaz y eficiente desde el punto de vista energético", afirma el Dr. Zaffagnini, coautor del estudio del Centro de Regulación Genómica.
Los agregados de proteínas pueden contribuir a la infertilidad
La fertilidad disminuye con la edad, y la mala calidad de los ovocitos es la principal causa de infertilidad femenina. Las tasas mundiales de infertilidad también están aumentando, siendo el retraso de la maternidad uno de los factores que contribuyen. Comprender cómo los ovocitos se mantienen sanos y qué hace que estas estrategias fallen con la edad es fundamental para comprender las causas inexplicables de la infertilidad y abrir nuevas vías de tratamiento.
Los hallazgos del estudio sugieren que la presencia de agregados proteicos podría interferir con la calidad tanto del óvulo como del embrión. Los autores del estudio eliminaron la capacidad de los ELVA para degradar los agregados de proteínas durante el proceso de maduración de los ovocitos. Este experimento condujo a la formación de óvulos defectuosos. Cuando el equipo científico "obligó" a los embriones a heredar proteínas agregadas, 3 de cada 5 (60%) no lograron completar etapas muy tempranas de desarrollo.
"Históricamente, muchos estudios se han centrado en un pequeño aspecto: por qué disminuye la calidad de los ovocitos, que son la meiosis y la euploidia. Un estudio reciente de once mil transferencias de embriones demostró que la disminución de la fertilidad femenina con la edad está muy influenciada por otros factores aún desconocidos. Nuestro estudio abre una dirección futura fascinante para explorar si la degradación de proteínas y los problemas con la forma en que se regulan en los ovocitos podrían explicar el deterioro de la salud embrionaria relacionado con la edad", concluye la Dra. Böke.
Otro tipo de célula longeva que no se divide pero que tiene que lidiar con agregados de proteínas son las neuronas. La acumulación de sustancias nocivas en estas células está relacionada con el desarrollo de varios tipos de enfermedades neurodegenerativas, incluido el Alzheimer. ¿Podrían existir compartimentos similares a ELVA también en neuronas y otros tipos de células? El estudio abre la puerta a futuras vías de investigación más allá del campo de la reproducción.
EN CATALÀ
Els ovòcits retenen i degraden proteïnes tòxiques per preservar la fertilitat a llarg termini
Els ovòcits són òvuls immadurs que es desenvolupen en gairebé totes les femelles mamíferes abans del naixement. La propagació de generacions futures depèn que aquesta reserva finita de cèl·lules sobrevisqui durant molts anys sense patir danys. En ratolins, això pot traduir-se en un període de fins a divuit mesos, mentre que en humans pot durar gairebé mig segle, el temps mitjà entre el naixement i la menopausa. Com les cèl·lules aconsegueixen aquesta gesta de longevitat és un misteri.
Un equip del Centre de Regulació Genòmica (CRG) de Barcelona ha descobert un nou mecanisme que explica com els ovòcits romanen en perfectes condicions durant dècades sense sucumbir al desgast que provocaria el fracàs en altres tipus cel·lulars. Les troballes, publicades a la revista Cell, representen una nova frontera per explorar les causes inexplicables de la infertilitat.
L'estudi se centra en els agregats de proteïnes, que són grups de proteïnes mal plegades o danyades. Si no es controlen, aquestes substàncies nocives s'acumulen al citoplasma i tenen efectes altament tòxics. Se sap que els agregats de proteïnes s'acumulen en les neurones i els seus efectes s'han relacionat amb diverses malalties neurodegeneratives. En general, les cèl·lules gestionen els agregats descomponent-los amb enzims especialitzats. També es poden dividir en dues noves cèl·lules, concentrant els agregats en una de les cèl·lules, sense afectar l'altra.
Però els ovòcits no són com les altres cèl·lules. La seva llarga vida significa que no poden dissipar substàncies tòxiques a través de la divisió cel·lular. Descompondre constantment els agregats de proteïnes és una estratègia inviable, ja que requereix usar molta energia que pot no estar disponible. Els ovòcits també donen tot el seu citoplasma a un embrió després de fusionar-se amb un espermatozoide, per la qual cosa prefereixen reduir la seva activitat metabòlica, una estratègia que evita generar subproductes que puguin danyar l'ADN matern i comprometre l'èxit reproductiu. Això fa que els ovòcits siguin particularment sensibles als efectes de les proteïnes mal plegades o danyades.
No obstant això, "a diferència de les desenes de milers d'articles sobre l'agregació de proteïnes en les neurones, la manera en què els ovòcits dels mamífers s'enfronten a l'agregació de proteïnes està essencialment sense estudiar, tot i tenir el mateix problema de ser longeus i no dividir-se", explica la Dra. Elvan Böke, cap del grup de Biologia d’Ovòcits i Latència Cel·lular del Centre de Regulació Genòmica i autora de l’estudi. "Volíem explorar com els ovòcits gestionen aquestes proteïnes mal plegades o danyades", afegeix la Dra. Böke.
"Equips de neteja" patrullant
L'equip de la Dra. Böke, dirigit per l'investigador postdoctoral Dr. Gabriele Zaffagnini, va començar recol·lectant milers d’ovòcits immadurs, òvuls madurs i embrions en estat de desenvolupament primerenc de ratolins. Fent servir tints especials, van observar com es comporten els agregats de proteïnes en temps real utilitzant una tècnica d'imatge especial. També van utilitzar la microscòpia electrònica per observar els detalls nanoscòpics dins de les cèl·lules. L'estudi va trigar cinc anys i mig a completar-se.
Van descobrir estructures especials en els ovòcits a les quals van anomenar Conjunts Vesiculars EndoLisosomals, o 'ELVAs' pel seu acrònim en anglès. Aquestes estructures -n'hi ha unes 50 per cada ovòcit- deambulen pel citoplasma, on capturen i retenen els agregats proteics, fent-los inofensius. Les cèl·lules tenen estructures subcel·lulars conegudes com a orgànuls, que realitzen treballs molt semblants als d'un òrgan al cos. Els autors de l'estudi conceptualitzen els ELVA com un "superorgànul" perquè és una xarxa de molts tipus diferents de components cel·lulars que treballen junts com una sola unitat.
L'estudi va revelar un moment crucial durant l'etapa de maduració de l’ovòcit: quan un ovòcit es converteix en un òvul madur, preparant-se per a l'ovulació i la possible fecundació. Durant aquesta etapa, es va observar que els ELVA es mouen cap a la superfície de la cèl·lula i descomponen els agregats de proteïnes, essencialment netejant el citoplasma en profunditat. Aquesta és la primera observació de la singular estratègia que empren els ovòcits per desfer-se dels agregats de proteïnes.
"Un ovòcit ha de donar tot el seu citoplasma a l'embrió en el moment de la fecundació, per la qual cosa no es pot permetre que s'hi acumulin escombraries, fet que suposaria un risc existencial per a la seva funció. En aquest sentit, els ELVA són com una sofisticada xarxa d'eliminació de residus o un equip de neteja que patrulla pel citoplasma per assegurar-se que no hi hagi agregats flotant lliurement. Els ELVA mantenen aquests agregats en un ambient confinat fins que l'ovòcit estigui llest per desfer-se'n d'un sol cop. És una estratègia eficaç i eficient des del punt de vista energètic", afirma el Dr. Zaffagnini, coautor de l'estudi del Centre de Regulació Genòmica.
Els agregats de proteïnes poden contribuir a la infertilitat
La fertilitat disminueix amb l'edat, i la mala qualitat dels ovòcits és la principal causa d'infertilitat femenina. Les taxes mundials d'infertilitat també estan augmentant, essent el retard de la maternitat un dels factors que hi contribueixen. Comprendre com els ovòcits es mantenen sans i què fa que aquestes estratègies fallin amb l'edat és fonamental per comprendre les causes inexplicables de la infertilitat i obrir noves vies de tractament.
Les troballes de l'estudi suggereixen que la presència d'agregats proteics podria interferir amb la qualitat tant de l'òvul com de l'embrió. Els autors de l'estudi van eliminar la capacitat dels ELVA per degradar els agregats de proteïnes durant el procés de maduració dels ovòcits. Aquest experiment va conduir a la formació d'òvuls defectuosos. Quan l'equip científic "va obligar" els embrions a heretar proteïnes agregades, 3 de cada 5 (60%) no van aconseguir completar etapes molt primerenques de desenvolupament.
"Històricament, molts estudis s'han centrat en un petit aspecte: per què disminueix la qualitat dels ovòcits, que són la meiosi i l’euploïdia. Un estudi recent d'onze mil transferències d'embrions va demostrar que la disminució de la fertilitat femenina amb l'edat està molt influenciada per altres factors encara desconeguts. El nostre estudi obre una direcció futura fascinant per explorar si la degradació de proteïnes i els problemes amb la forma en què es regulen en els ovòcits podrien explicar el deteriorament de la salut embrionària relacionat amb l'edat", conclou la Dra. Böke.
Un altre tipus de cèl·lula longeva que no es divideix però que ha de gestionar agregats de proteïnes són les neurones. L'acumulació de substàncies nocives en aquestes cèl·lules està relacionada amb el desenvolupament de diversos tipus de malalties neurodegeneratives, inclòs l'Alzheimer. ¿Podrien existir compartiments similars a ELVA també en neurones i altres tipus de cèl·lules? L'estudi obre la porta a futures vies d'investigació més enllà del camp de la reproducció.