NOTÍCIES
NOTÍCIES
Turning X chromosome “off and on again” critical for oocyte development
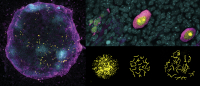
On the left is an artificial ovary, where in vitro-generated female germ cells (magenta) enter meiosis (yellow cells) to become oocytes with the help from supporting cells (cyan). This process is 4-times more efficient when the X chromosome is correctly turned OFF and ON again during germ cell development. The top right panel shows oocytes at different maturation stages: from more immature on the left to more advanced on the right. The lower right panel shows the chromosomal organization during the meiosis process when germ cells become unique by reshuffling their genetic material. Credit: Dr. Jacqueline Severino/CRG
Researchers at the Centre for Genomic Regulation (CRG) in Barcelona have identified a potential new diagnostic marker that predicts the successful and efficient development of mammalian egg cells. The findings could pave the way for generating artificial oocytes in the laboratory, helping researchers study the causes and treatments of infertility disorders and test the impact of drugs and chemicals on women’s reproduction. The research is published in The EMBO Journal.
Humans have 23 pairs of chromosomes. Between males and females, 22 pairs are shared, with the 23rd pair being the sex chromosomes. Males usually have an X and a Y chromosome, while females have two X’s. This presents a potential problem for the female cellular machinery, as two active X chromosomes generate an overdose of gene products, which is fatal for developing embryos or leads to cancer in adult life. To avoid this scenario, female cells inactivate one X chromosome by turning off its genes and compacting it.
Little is known about how X-chromosome inactivation affects the development of reproductive cells. In mammals, oocytes develop from germ cells, precursor cells that migrate from early embryonic tissue to the developing gonads. Germ cells then undergo meiosis, an important chromosomal rearrangement process, which is responsible for the genetic uniqueness of each individual germ cell. Germ cells mature and eventually turn into functional sperm or oocytes.
To address this question, researchers at the Centre for Genomic Regulation (CRG) built an X-chromosome reporter system (XRep), a tool which allowed them to study how the chromosome shapeshifts over time during germ cell development in vitro.
Using female mouse cells, the method revealed a carefully orchestrated act of X-chromosome ‘yoyo’. If one X chromosome briefly inactivated and then reactivated, it resulted in germ cells being four times more efficient for entering meiosis and transforming into egg cells compared to germ cells that have never turned their X chromosome ‘off and on’ again. In comparison, germ cells that failed to inactivate the X chromosome in the first place or reactivated it too rapidly showed abnormal gene expression and cell differentiation patterns.
The study also found that cells with two active X chromosomes divided faster and easily reverted into a state of pluripotency. According to the authors, these characteristics are similar to human germ cell tumors, which come from germ cells that got lost during their migration to the gonads or failed to differentiate properly once inside the testicles and ovaries. The researchers deduced that a correct X-chromosome inactivation and reactivation sequence is an indicator of normal germ cell differentiation. The research team notes that further studies will be needed to confirm whether an abnormal X-chromosome state is a diagnostic indicator, or whether it could be a causal factor responsible for the cell abnormality.
“Our findings have important implications for reproductive research because XRep allows us to assess cellular X-chromosome status in real time, helping identify and isolate germ cells with a high success rate of turning into oocytes,” says Dr. Bernhard Payer, Group Leader at the CRG and senior author of the study.
“Human oocytes have never been generated completely in vitro. Monitoring the X-chromosome state during in vitro germ cell differentiation might therefore be a way to optimize the protocol to produce also high quality human eggs in the lab. Human eggs for research are scarce and difficult to obtain because they are currently only available from egg donors and mostly used for reproductive purposes. In vitro-generated human eggs could therefore provide an unlimited resource to study the causes and treatments of infertility disorders and as well to test the safety of drugs and chemicals for women’s reproduction”, concludes Dr. Payer.
Dr. Moritz Bauer, co-first author of the study, adds: “Our results also highlight how we need specific tools to study female cells. The vast majority of studies are performed using male cells, leading to a gender-gap in scientific knowledge. We therefore need to stop looking at female development through the lens of male cells, which will contribute to our understanding of sex-specific disease progressions.”
EN CASTELLANO
“Apagar y encender” el cromosoma X es fundamental para el desarrollo de los ovocitos
Un equipo científico del Centro de Regulación Genómica (CRG), en Barcelona, ha identificado un posible marcador de diagnóstico que predice la eficacia y eficiencia del desarrollo de los óvulos en mamíferos. Los hallazgos podrían allanar el camino para generar ovocitos artificiales en el laboratorio, algo que contribuiría a la investigación de las causas y tratamientos de los trastornos de infertilidad y probaría el impacto de fármacos o de productos químicos en la reproducción humana. El estudio se publica hoy en The EMBO Journal.
Los humanos tienen 23 pares de cromosomas. Los hombres y las mujeres compartimos 22 de los pares, y los dos que componen el vigésimo tercer par son los cromosomas sexuales. Los hombres suelen tener un cromosoma X y uno Y, mientras que las mujeres tienen dos X. Esto presenta un desafío para la maquinaria celular femenina, ya que tener dos cromosomas X activos genera una sobredosis de productos génicos, un factor mortal para los embriones en desarrollo o un factor carcinógeno para adultos. Para evitar este escenario, las células femeninas inactivan uno de los dos cromosomas X, apagando sus genes y compactándolo.
Se sabe muy poco sobre el impacto que tiene la inactivación del cromosoma X sobre el desarrollo de las células reproductivas. En los mamíferos, los ovocitos se desarrollan a partir de células germinales, células precursoras que migran desde el tejido embrionario hasta las gónadas, que están en la etapa temprana de desarrollo. Aquí las células germinales se dividen por meiosis, un importante proceso de reordenamiento cromosómico que es responsable de la singularidad genética de cada célula germinal. Las células germinales maduran y finalmente se convierten en espermatozoides u ovocitos funcionales.
Para abordar esta pregunta, un equipo científico del Centro de Regulación Genómica (CRG) construyó un sistema de seguimiento del cromosoma X (XRep), una herramienta que les permitió estudiar cómo cambia la forma del cromosoma en tiempo real durante el desarrollo de células germinales in vitro.
Usando células de ratón hembra, el método reveló un acto de yoyó cuidadosamente orquestado en el cromosoma X. Si un cromosoma X previamente inactivado se reactivaba, las células germinales eran cuatro veces más eficientes para entrar en la fase de meiosis y transformarse en óvulos en comparación con las células germinales que nunca habían vuelto a "apagar y encender" su cromosoma X. Las células germinales que no lograron inactivar el cromosoma X en primer lugar o lo reactivaron demasiado rápido mostraron patrones anormales de expresión génica y diferenciación celular.
El estudio también halló que las células con dos cromosomas X activos se dividían más rápido y revertían fácilmente a un estado de pluripotencia. Según los autores, esta característica es parecida a los tumores causados por células germinales en humanos, que provienen de células germinales que se perdieron durante su migración a las gónadas, o que no lograron diferenciarse adecuadamente una vez dentro de los testículos y los ovarios.
Por estas razones, el equipo científico dedujo que la secuencia correcta de inactivación y reactivación del cromosoma X es un indicador de la diferenciación normal de las células germinales. El equipo de investigación señala que se necesitarán más estudios para confirmar si un estado anormal del cromosoma X es un indicador de diagnóstico o si podría ser un factor causal responsable de la anomalía celular.
"Nuestros hallazgos tienen implicaciones importantes para la investigación reproductiva porque XRep nos permite evaluar el estado del cromosoma X celular en tiempo real, lo que ayuda a identificar y aislar las células germinales que tengan una gran probabilidad de convertirse en ovocitos", dice el Dr. Bernhard Payer, jefe de grupo en el CRG y autor principal del estudio.
“Los ovocitos humanos nunca se han generado completamente in vitro. Por lo tanto, la monitorización del estado del cromosoma X durante la diferenciación de células germinales in vitro podría ser una forma de optimizar el protocolo para producir óvulos humanos de alta calidad en el laboratorio. Los óvulos humanos destinados a la investigación son escasos y difíciles de conseguir porque actualmente su disponibilidad depende de las donantes y se utilizan principalmente para fines reproductivos. Por lo tanto, los óvulos humanos generados in vitro podrían proporcionar un recurso ilimitado para estudiar las causas y los tratamientos de los trastornos de infertilidad y también para probar la seguridad de los fármacos o productos químicos para la reproducción humana”, concluye el Dr. Payer.
El Dr. Moritz Bauer, coautor del estudio, agrega: “Nuestros resultados también resaltan la necesidad de herramientas específicas para estudiar las células femeninas. La gran mayoría de los estudios se realizan con células masculinas, lo que genera una brecha de género en el conocimiento científico. Por lo tanto, debemos dejar de mirar el desarrollo femenino a través de la lente de las células masculinas, lo que contribuirá a la comprensión de las progresiones de las enfermedades específicas de cada sexo”.
EN CATALÀ
“Apagar i encendre” el cromosoma X és fonamental per al desenvolupament dels ovòcits
Un equip científic del Centre de Regulació Genòmica (CRG), a Barcelona, ha identificat un possible marcador de diagnòstic que prediu l’eficàcia i l’eficiència del desenvolupament dels òvuls en mamífers. Les troballes podrien aplanar el camí per a generar ovòcits artificials al laboratori, fet que contribuiria a l’estudi de les causes i tractaments dels trastorns d’infertilitat i provaria l’impacte de fàrmacs o de productes químics en la reproducció humana. L’estudi es publica avui a The EMBO Journal.
Els humans tenen 23 parells de cromosomes. Els homes i les dones compartim 22 dels parells, i els dos que composen el vint-i-tresè parell són els cromosomes sexuals. Els homes solen tenir un cromosoma X i un Y, mentre que les dones tenen dos X. Això presenta un repte per a la maquinària cel·lular femenina, ja que tenir dos cromosomes X actius genera una sobredosi de productes gènics, un factor mortal per als embrions en desenvolupament o un factor cancerigen per a les persones adultes. Per evitar aquest escenari, les cèl·lules femenines inactiven un dels dos cromosomes X, apagant els seus gens i compactant-lo.
Se sap molt poc sobre l’impacte que té la inactivació del cromosoma X sobre el desenvolupament de les cèl·lules reproductives. En els mamífers, els ovòcits es desenvolupen a partir de cèl·lules germinals, cèl·lules precursores que migren des del teixit embrionari fins a les gònades, que estan en l’etapa primerenca de desenvolupament. Aquí les cèl·lules germinals es divideixen per meiosi, un important procés de re-ordenament cromosòmic que és responsable de la singularitat genètica de cada cèl·lula germinal. Les cèl·lules germinals maduren i finalment es converteixen en espermatozous o ovòcits funcionals.
Per abordar aquesta pregunta, un equip del Centre de Regulació Genòmica (CRG) construí un sistema de seguiment del cromosoma X (XRep), una eina que els permeté estudiar com canvia la forma del cromosoma en temps real durant el desenvolupament de cèl·lules germinals in vitro.
Emprant cèl·lules de ratolí femella, el mètode revelà un acte de io-io curosament orquestrat al cromosoma X. Si un cromosoma X prèviament inactivat es reactivava, les cèl·lules germinals eren quatre vegades més eficients per a entrar en la fase de meiosi i transformar-se en òvuls, en comparació amb les cèl·lules germinals que mai no havien tornat a “apagar i encendre” el seu cromosoma X. Les cèl·lules germinals que no aconseguiren inactivar el cromosoma X en primer lloc o el reactivaren massa ràpid mostraren patrons anormals d’expressió gènica i diferenciació cel·lular.
L’estudi també trobà que les cèl·lules amb dos cromosomes X actius es dividien més ràpid i revertien fàcilment a un estat de pluripotència. Segons els autors, aquesta característica és semblant als tumors causats per cèl·lules germinals en humans, que provenen de cèl·lules germinals que es perderen durant la migració a les gònades, o que no aconseguiren diferenciar-se adequadament un cop dins dels testicles i els ovaris.
Per aquestes raons, l’equip científic deduí que la seqüència correcta d’inactivació i reactivació del cromosoma X és un indicador de la diferenciació normal de les cèl·lules germinals. L’equip d’investigació assenyala que es necessitaran més estudis per confirmar si un estat anormal del cromosoma X és un indicador de diagnòstic o si podria ser un factor causal responsable de l’anomalia cel·lular.
“Les nostres troballes tenen implicacions importants per a la recerca reproductiva perquè XRep ens permet avaluar l’estat del cromosoma X cel·lular en temps real, fet que ajuda a identificar i aïllar les cèl·lules germinals que tinguin una gran probabilitat de convertir-se en ovòcits”, diu el Dr. Bernhard Payer, cap de grup al CRG i autor principal de l’estudi.
“Els ovòcits humans mai s’han generat completament in vitro. Per tant, la monitorització de l’estat del cromosoma X durant la diferenciació de cèl·lules germinals in vitro podria ser una manera d’optimitzar el protocol per a produir òvuls humans d’alta qualitat al laboratori. Els òvuls humans destinats a la recerca són escassos i difícils d’aconseguir perquè actualment la seva disponibilitat depèn de les donants i s’utilitzen principalment amb fins reproductius. Així doncs, els òvuls humans generats in vitro podrien proporcionar un recurs il·limitat per a estudiar les causes i els tractaments dels trastorns d’infertilitat i també per provar la seguretat dels fàrmacs o productes químics per a la reproducció humana”, conclou el Dr. Payer.
El Dr. Moritz Bauer, coautor de l’estudi, afegeix: “Els nostres resultats també ressalten la necessitat d’eines específiques per a estudiar les cèl·lules femenines. La gran majoria dels estudis es realitzen amb cèl·lules masculines, fet que genera una bretxa de gènere en el coneixement científic. És per això que hem de deixar de mirar el desenvolupament femení a través de l’òptica de les cèl·lules masculines, fet que contribuirà a la comprensió de les progressions de les malalties específiques de cada sexe”.